WHO预认证:中国药企陌生的掘金机会
世界卫生组织(WHO)供应商预认证(WHO Pre-qualification,下称“WHO预认证”)是我国药企通向国际市场的1道质量门。不过,截至目前,在已通过WHO预认证可以进入全球采购的目录上,中国产品的数量却寥寥可数,中国药品和疫苗通过WHO预认证的数量分别仅为22个和2个,远不及印度。
“通过WHO预认证以后,就国际市场而言,企业将直接面对公共市场的采购,这对发展中国家是1个支持,对药企来讲是1个提升。”世界卫生组织驻华代表处的扩大免疫计划组项目官员唐轶告知第1财经记者,“对国内市场来讲,首先是将具有更多的高质量产品,这些产品通过预认证后,将提升本身的生产质量和管理水平,这也有益于国内市场及本国老百姓。”
国家卫计委国际交换与合作中心主任高卫中8月14日表示,“在1带1路的倡议中,中国将为世界提供重要的公共产品,但我们在医疗和疫苗这方面,通过WHO预认证的数量还不够多。”
WHO预认证的门坎高?
WHO预认证,是2001年启动的联合国行动计划,用于扩大可供选择的优先药物品种,目标是确保国际基金(如全球基金GFTAM、联合国支援国际药品采购机制UNITAID等)采购药品的质量、疗效和安全性,服务发展中国家的患者。
“通过WHO预认证,就意味着世卫组织对该药品/疫苗的安全性和效率表示认可,联合国采购机构便可将这1药品/疫苗列入它的采购目录。”唐轶表示。
在这以后,WHO、全球基金、联合国组织(如UNFPA,UNICEF),还有1些国际慈善机构便开始推动这些药品的全球采购,然后对发展中国家提供相干支持。条件就是,这些采购名单的产品必须经过WHO预认证这道质量门坎。
在已通过WHO预认证产品的数量上,中印两国依然存有差距。印度通过WHO预认证的药品数量为336个,中国只有22个,印度通过WHO预认证的疫苗数量有44个,中国仅为2个。
“差距这么大,主要缘由在于中国起步相对印度较晚,而印度通过预认证的疫苗数量要多于中国,说明它的疫苗监管是到达了WHO预认证要求。”唐轶表示,“从企业角度来看,要通过WHO预认证还受多种因素影响,特别是疫苗企业的水平,我们认为中国企业比较薄弱的领域主要在质量管理体系,和沟通的能力。而这些方面,印度要普遍高于中国。”
中国是全球第2大药品市场,同时是仿造药大国、原料药大国,原料药以1600多种位居全球原料药生产能力第1,疫苗以年产量10亿剂的产量一样位居全球第1,但是中国目前能够在全球大量供应的就只有原料药。
盖茨基金会北京代表处副主任吴文达告知第1财经,印度的药品市场没有中国那末大,因此他们在刚开始投入阶段就斟酌到了国际市场,在研发、做产品的起步阶段就依照WHO的标准来,而不是依照国内标准。
与印度相比,面对中国如此大的市场,只要做好中国市场,中国企业就已可以赚到盆满钵满。“20年前,我和同事把WHO预认证引入中国时,当时没有人感兴趣。首先是当时的国家药监体系没有通过WHO认证,同时疫苗企业的研产生产也都不符合这个标准。”1位最早参与WHO预认证的专家表示。
值得1提的是,与药品相比,疫苗通过WHO预认证要多1个条件,即中国药监体系必须要先通过WHO的评估,才能进行疫苗的WHO预认证。而中国药监体系直到2010年才通过这1评估,随后疫苗才开始进行预认证申报。因此,中国疫苗通过WHO预认证的数目少,也跟中国药监体系通过预认证的早晚有关系。
吴文达表示:“中生团体成都所的乙脑疫苗在2013年通过了WHO预认证,到目前为止,已出口了4亿支疫苗,所以出口量还是蛮大的。”
而已获得WHO预认证的产品想进入其他国家,虽然一样面临注册,但相对要简单许多。“非洲有510几个国家,1个个跑很麻烦,因而有1些非洲国家药政当局建立了合作机制,这些国家认可世卫组织的预认证产品,因此只要经过预认证的产品,通过这个机制就可以很快用到这些国家,这对企业来讲也节省了本钱。另外,如果产生变更,也不需要逐1国家去办理变更的注册手续。”吴文达表示。
事实上,在通过WHO预认证以后,不但要把质量好的产品提供到国外,企业在国内的产品也要同质。“我们的监管机构和世卫组织是在延续进行沟通的,申报预认证不允许采取两重标准,不管监管机构还是企业都不允许。”唐轶表示。
另外,在唐轶看来,中国通过WHO预认证的产品数量少还有另外1个缘由,那就是利润。作为带有公益性质的全球健康采购,用最少的钱做最多的事情天经地义,但这并不是代表没有益润。
“想通过WHO预认证的产品,企业需要先提升质量,也就是要投入本钱。是本钱还是利润,这也是企业要斟酌的因素。”唐轶表示,不过从另外一方面讲,1旦通过WHO预认证,产品进入国际市场后,国际组织等大范围的采购将为这些企业带来可观的利润。
中国药企面临本钱考量
事实上,不管中国企业是不是要做WHO预认证,其药品和疫苗的质量提升都已势在必行,特别是在中国全面展开仿造药1致性评价,和国家食药监总局加入ICH(国际人用药品注册技术调和会)后。
唐轶告知第1财经:“想通过WHO预认证,必须要先提升质量,在这个进程中,提高本钱是肯定的。”
对企业而言,自始至终都需要斟酌投入与产出问题。在中国仿造药1致性评价的进程中,本来具有很多产品和批号的企业,现在已开始瘦身,毕竟做完1个药品的1致性评价,需要先投入500万~1000万元的本钱。
浙江省食药监局近日发布的《浙江省拟不展开仿造药质量和疗效1致性评价的品种信息》显示,该省有32家药企放弃了160个药品,不再展开仿造药1致性评价。
“对企业来说,仿造药1致性评价需要投入大量的人力、物力和财力,具有很多批号的企业都需要做1个研判:如果自己的产品不具有优势,那末为提升质量而投入这么大的本钱就不适合了,因此每一个企业都有放弃1些(产品)。”1位药品专家表示。
因而可知,提高药品或疫苗的质量,这条路走起来仿佛没有那末容易。
吴文达举了个例子:“中国的乙脑疫苗在2013年拿到了WHO预认证,前后花了9年时间,大概投放了4000万美元给不同的机构做技术支持,还有重新做临床实验、厂房改造、生产规则等,企业也投入了更多的钱做了内部改造。目前已有超过4亿支疫苗送到中国之外的地区。老挝在2015年有150万小孩接种了成都所生产的乙脑疫苗。”
吴文达认为,虽然乙脑疫苗拿到WHO预认证的时间晚,但它对全部公卫健康的影响非常大。
乙脑疫苗获得WHO预认证的进程走了很长1段路,这表明中国的疫苗产业跟国际质量标准的要求还有距离。但其实,这个案例也显示出,中国的医药产业跟世界的距离其实不是真的很遥远,关键在于你看到的有多远。
“印度的疫苗,1开始在市场定位方面就与中国不同,造成了起步的早晚不同。但我们在硬件方面1点都不差,差的就是所谓的软件方面,包括文件系统、对良好规范的理解和实行、质量观念等,这是中国企业普遍存在的问题。”唐轶表示,就国内WHO预认证现状而言,说起来简单,做起来不容易。很多化药,申请以后,由于各方面缘由,没法完成审评或检查,或是检查了以后没法完成整改,也就不了了之了。
盖茨基金会高级项目官陈园告知第1财经,中国的仿造药1致性评价把生物等效性实验往前推,中国化药、仿造药会逐渐到达国际水平,未来在欧美注册的中国仿造药数量可能会呈井喷趋势,而在WHO化药的预认证数量里也将是上升趋势,这都是可以预期的。
-
波士顿科学宣布达成Intera Oncology® Inc.医疗器械公司收购协议
——该收购为肿瘤介入产品组合新增了治疗肝转移瘤的补充疗法 马萨诸塞州马尔伯勒2024年11月26日 /美通社/ -- 近日...[详细]
-
诺和诺德亮相第二届链博会:以"链"会友,共筑健康未来
北京2024年11月26日 /美通社/ -- 今日,第二届中国国际供应链促进博览会(简称"链博会")在北京盛大开幕。...[详细]
-
富士胶片与上海理工大学合作医疗器械实践教育基地正式揭牌
上海2024年11月26日 /美通社/ -- 11月20日,上海理工大学医疗器械校外实践基地在富士胶片智慧医疗技术培训中心揭牌...[详细]
-
AsiaPay为亚太区女性领导企业提供4万澳元奖金
连续第二年支持女性创业者推动积极变革 澳大利亚墨尔本2024年11月26日 /美通社/ -- 为女性创业者赋能的全球平台...[详细]
-
赛诺菲"奇迹紫赛道"亮相第二届链博会
追寻免疫健康链路,点亮生命赛道 北京2024年11月26日 /美通社/ -- 全球领先的创新医药健康企业赛诺菲首次参展第二...[详细]
-
上药牌®麝香保心丸、胆宁片及正气片入选家庭常备药榜单
上海2024年11月25日 /美通社/ -- 近日,备受瞩目的"2023-2024家庭常备药"上榜品牌活动结果揭晓。上海和黄药业...[详细]
-
-
泰康拜博优秀病例荣誉入选ORF Talent Discovery全球病例大赛巅峰总决赛20...
上海、深圳和北京2024年11月22日 /美通社/ --近日
-
卫材抗癌药物"TASFYGO®片剂35mg"在日本上市
用于治疗携带FGFR2基因融合或重排的胆道癌 东
-
佳得乐与曼城球员共同揭晓 #THENOD 在足球场上的无声超凡力量
佳得乐 (Gatorade) 的广告牌现已正式出现在欧洲
-
对您来说,干净的洗手间有多重要? 最新全球调查揭示后疫情时代人们对商用洗手间的看法
Excel Dryer, Inc.与MetrixLab的研究表明
-
默沙东与中国癌症基金会签署HPV疫苗捐赠协议
加速消除宫颈癌 共筑HPV健康防线 北京2024年11
-
"爱肺骑行,你我相伴"2024健康骑行公益活动圆满举行
上海2024年11月23日 /美通社/ -- 11月是国际肺癌关
-
-
-
肝纤维化不能吃什么?肝纤维化饮食的注意事项有哪些?
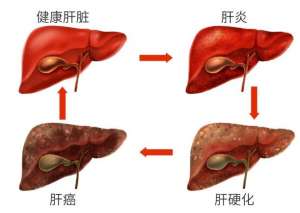
中国人口14亿多,其中有9000万乙肝病毒感染者
-
肝硬化需要全疗程用药吗?哪个品牌的软肝片好?用药讲疗程,安全有保证!
人们常说“慢性病要以慢治慢”。古人倡导“
-
肝硬化的突出表现有哪些?用什么药软肝效果好?保肝软肝就选中成药
肝硬化是一种常见慢性病,引起肝硬化的病因
-
肝硬化的前期表现有哪些?肝硬化前期该如何选择软肝药品呢?
中国人的饮酒文化众所皆知,都特别喜欢酒桌
-
肝硬化患者吃什么药好,复方鳖甲软肝片有效吗?疗效值得认可
我国是肝病高发生率大国,每年有超过120万病
-
肝硬化吃复方鳖甲软肝片怎么样?复方鳖甲软肝片功效与作用来评价
肝硬化是一种常见的慢性肝病,是由一种或多
-
-
-
-
-
-
-
-
-
-
-
-
-
 优养在线
优养在线