云顶新耀授权合作伙伴辉瑞宣布美国FDA批准伊曲莫德(etrasimod)用于治疗溃疡性结肠...
中国上海2023年10月16日 /美通社/ -- 云顶新耀(HKEX 1952.HK)的授权合作伙伴辉瑞公司(纽约证券交易所股票代码:PFE )宣布美国食品药品监督管理局(FDA)已批准每日一次口服的选择性鞘氨醇-1-磷酸(S1P)受体调节剂伊曲莫德(VELSIPITY™, etrasimod)用于治疗中重度活动性溃疡性结肠炎(UC)的成人患者。云顶新耀正在亚洲开展伊曲莫德(etrasimod)的多中心3期临床研究,争取尽早提交其在云顶授权范围的新药上市许可申请(NDA)。
云顶新耀首席执行官罗永庆表示:“祝贺我们的合作伙伴达成了这一重要里程碑,将为溃疡性结肠炎患者提供他们迫切所需的创新、疗效好且服用方便的治疗方案。伊曲莫德是一种经过临床验证的有效治疗方法,具有良好的临床获益和安全性,与其他 S1P 调节剂不同的是,伊曲莫德在诱导阶段不需要调整剂量。同时,我们的合作伙伴还在开展其针对克罗恩病、特应性皮炎、嗜酸细胞食管炎、斑秃等多种适应症的临床研究,伊曲莫德有望成为广谱的自身免疫疾病重磅药物。近年来,中国的溃疡性结肠炎和其他自免性疾病发病率迅速上升,我们期待能够尽快推进亚洲的3期临床研究,早日在中国及其它亚洲国家和地区完成注册上市。”
伊曲莫德(etrasimod)亚太临床试验牵头研究者、世界胃肠病学会常务理事、中华医学会消化病学分会副主任委员、中国人民解放军第四军医大学附属西京医院吴开春教授表示:“Etrasimod在美国FDA获批是一个非常重要的里程碑,可为中重度活动性溃疡性结肠炎患者提供新的治疗选择。该疾病的患者通常会尝试不同的治疗方法,有些患者对使用注射疗法(如生物制剂)有顾虑。而Etrasimod具有良好的获益-风险特征,这种新一代S1P调节剂通过口服、每日一次的治疗方案即可达到无激素缓解,可为患者带来更先进便捷的治疗选择。目前亚太临床试验患者招募已完成,期待中国及其他亚洲国家早日获批,造福更多患者。”
到2030年,中国的溃疡性结肠炎患者人数预计将比2019年增加一倍以上,达到约100万人,这表明中国市场对于该疾病的创新疗法存在巨大未满足需求。伊曲莫德(etrasimod)由Arena Pharmaceuticals公司开发,辉瑞于2022年完成了对Arena Pharmaceuticals的收购,而云顶新耀早在2017年已从Arena获得了在大中华区和韩国开发、生产和商业化伊曲莫德(etrasimod)的独家权利。
此次美国FDA的批准是基于ELEVATE UC 3期注册性研究(ELEVATE UC 52和ELEVATE UC 12)的结果,该研究旨在评价既往对至少一种常规治疗、生物制剂或JAK抑制剂治疗失败或不耐受的溃疡性结肠炎患者,每日一次服用2mg etrasimod的安全性和疗效。这两项随机、双盲、安慰剂对照研究均达到了所有主要和关键次要终点,安全性特征与既往研究一致。
在ELEVATE UC 52研究中,第12周时,接受伊曲莫德(etrasimod)治疗的患者临床缓解率为27.0%,而安慰剂对照组的临床缓解率为7.0%(差异为20.0%,P=<.001);第52周时,接受伊曲莫德(etrasimod)治疗的患者临床缓解率为32.0%,而安慰剂对照组的临床缓解率为7.0%(差异为26.0%,P=<.001)。在ELEVATE UC 12研究中,接受伊曲莫德(etrasimod)治疗的患者临床缓解率为26.0%,而安慰剂对照组的临床缓解率为15.0%(差异为11.0%,P=<.05)。所有关键次要终点均在第12周达到,包括内镜改善和粘膜愈合。伊曲莫德(etrasimod)的安全性与之前的研究一致,最常见的不良反应是头痛和头晕(发生率≥5%)。
关于伊曲莫德(etrasimod)
伊曲莫德(etrasimod)是一种每日一次口服的选择性鞘氨醇-1-磷酸(S1P)受体调节剂,采用优化的药理学设计,与S1P受体1、4和5结合。
伊曲莫德治疗溃疡性结肠炎的新药上市申请已在多国递交,包括加拿大、澳大利亚、墨西哥、俄罗斯、瑞士和新加坡。欧洲药品管理局 (EMA) 已接受其新药上市申请 (MAA),预计将于 2024 年初做出决定。
关于ELEVATE UC 52和ELEVATE UC 12
ELEVATE UC 52和ELEVATE UC 12是ELEVATE UC 3 期注册性研究中的关键性试验。
ELEVATE UC 52是一项随机、双盲、安慰剂对照试验,包括12周的诱导期和40周的维持期。从第12周开始,所有患者均可继续接受其随机治疗;与基线时相比,疾病无改善或疾病恶化的患者可以停止治疗,符合条件的患者可入组开放扩展研究。该试验的主要目的是评估每日一次服用2mg 伊曲莫德(etrasimod)在12周和52周治疗后的安全性和达到临床缓解的疗效性。主要终点是临床缓解,定义为基于梅奥评分中3个子项的改善,包括排便次数单项评分为0(或为1且较基线降低至少为1分,便血单项评分为0,内镜单项评分<=1 (排除易脆)。在ELEVATE UC 52中,第12周时,接受伊曲莫德(etrasimod)治疗的患者和接受安慰剂的患者的临床缓解率分别为27.0%和7.0%(20.0%差异,P˂.001),第52周时分别为32.0%和7.0%(26.0%差异,P˂.001)。所有关键次要终点(包括第12周和第 52 周时的内镜改善和粘膜愈合情况以及第52周时的无激素缓解和持续临床缓解)均达到统计学显著性改善。
ELEVATE UC 12是一项随机、双盲、安慰剂对照试验,旨在评估中重度活动性溃疡性结肠炎患者每日一次服用2mg 伊曲莫德(etrasimod)的疗效和安全性。该试验的主要目的是评估伊曲莫德(etrasimod)在12周治疗后的安全性和达到临床缓解的疗效,评估基于FDA要求的3个子项的改良梅奥评分。在ELEVATE UC 12中,26.0%接受伊曲莫德(etrasimod)治疗的患者和15%接受安慰剂的患者临床症状得到缓解(11.0%差异,P <.05)。第12周时达到了试验的所有关键次要终点,包括内镜改善和粘膜愈合。
在ELEVATE UC 12中,伊曲莫德(etrasimod) 2mg治疗组和安慰剂治疗组发生治疗中出现的不良事件(AE)的患者比例相似,而在ELEVATE UC 52中,etrasimod 2 mg组的这一比例高于安慰剂组。两项试验中各治疗组之间发生严重不良事件的患者比例相似。在两项试验中,截至第52周,伊曲莫德(etrasimod)治疗组中发生率为3%及以上且高于安慰剂组的最常见治疗中出现的不良事件为头痛、UC加重、COVID-19感染、头晕、发热、关节痛、腹痛和恶心。没有报告心动过缓或房室阻滞的严重不良事件。试验数据表明,启动etrasimod治疗不需要复杂的向上滴定方案。
在ELEVATE UC 52和ELEVATE UC 12中,分别有近三分之二的患者既往从未接受过生物制剂或JAK抑制剂治疗。
关于云顶新耀
云顶新耀是一家专注于创新药和疫苗开发、制造及商业化的生物制药公司,致力于满足亚洲市场尚未满足的医疗需求。云顶新耀的管理团队在中国及全球领先制药企业从事过高质量临床开发、药政事务、化学制造与控制(CMC)、业务发展和运营,拥有深厚的专长和丰富的经验。云顶新耀已打造多款有潜力成为全球同类首创或者同类最佳的药物组合,其中大部分已经处于临床试验后期阶段。公司的治疗领域包括肾科疾病、感染性和传染性疾病、自身免疫性疾病。有关更多信息,请访问公司网站:
前瞻性声明:
本新闻稿所发布的信息中可能会包含某些前瞻性表述,乃基于本公司或管理层在做出表述时对公司业务运营情况及财务状况的现有看法、相信、和现有预期,可能会使用“将”、“预期”、“预测”、“期望”、“打算”、“计划”、“相信”、“预估”、“确信”及其他类似词语进行表述。这些前瞻性表述并非对未来业绩的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展等各种因素及假设的影响,实际结果可能会与前瞻性表述所含资料有较大差别。本公司及各附属公司、各位董事、管理人员、顾问及代理未曾且概不承担更新该稿件所载前瞻性表述以反映在本新闻稿发布日后最新信息、未来项目或情形的任何义务,除非法律要求。
本文RSS来源:美通社
-
默沙东与中国癌症基金会签署HPV疫苗捐赠协议
加速消除宫颈癌 共筑HPV健康防线 北京2024年11月23日 /美通社/ -- 在今日举行的中国癌症基金会成立40周年纪念暨首届...[详细]
-
对您来说,干净的洗手间有多重要? 最新全球调查揭示后疫情时代人们对商用洗手间的看法
Excel Dryer, Inc.与MetrixLab的研究表明:如果洗手间不干净,顾客可能不会再光顾 马萨诸塞州东朗梅多20...[详细]
-
佳得乐与曼城球员共同揭晓 #THENOD 在足球场上的无声超凡力量
佳得乐 (Gatorade) 的广告牌现已正式出现在欧洲冠军联赛和足球游戏 EA SPORTS FC™25 的场边,实现了真实和虚拟足球世...[详细]
-
泰康拜博优秀病例荣誉入选ORF Talent Discovery全球病例大赛巅峰总决赛20...
上海、深圳和北京2024年11月22日 /美通社/ --近日,由口腔重建基金会(ORF)举办的2024口腔重建国际研讨会在湄南河...[详细]
-
卫材抗癌药物"TASFYGO®片剂35mg"在日本上市
用于治疗携带FGFR2基因融合或重排的胆道癌 东京2024年11月22日 /美通社/ -- 卫材宣布,已在日本上市成纤维细胞生长...[详细]
-
先瑞达血栓抽吸导管专用支撑管获NMPA批准上市
北京2024年11月22日 /美通社/ -- 2024年11月21日,先瑞达血栓抽吸导管专用支撑管获NMPA批准上市,该产品适用于在外周...[详细]
-
-
晨泰医药佐利替尼片(泽瑞尼®)获批上市
晨泰医药佐利替尼片(泽瑞尼®)是全球首个
-
药明康德获2024年EcoVadis企业社会责任评级"金牌"认证
上海2024年11月21日 /美通社/ -- 药明康德近日宣
-
擎科基因工厂揭秘(上):自研原料设备 打造全自主产业链
北京2024年11月21日 /美通社/ -- 合成科学融合了
-
擎科生物2024年高分文献集锦,前沿研究与产品创新助力科研突破
北京2024年11月21日 /美通社/ -- 自成立以来,擎
-
擎科基因工厂揭秘(下):高效Oligo合成,基因合成最快3天内可交付
北京2024年11月21日 /美通社/ -- 在前篇文章中,
-
用于肌萎缩性脊髓侧索硬化症的注射用25毫克 ROZEALAMIN®(甲钴胺)在日本上市
东京2024年11月21日 /美通社/ -- 卫材宣布,肌萎
-
-
-
肝纤维化不能吃什么?肝纤维化饮食的注意事项有哪些?
中国人口14亿多,其中有9000万乙肝病毒感染者
-
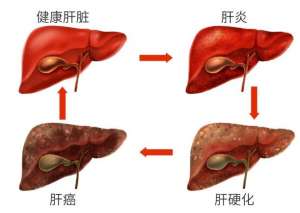
肝硬化需要全疗程用药吗?哪个品牌的软肝片好?用药讲疗程,安全有保证!
人们常说“慢性病要以慢治慢”。古人倡导“
-
肝硬化的突出表现有哪些?用什么药软肝效果好?保肝软肝就选中成药
肝硬化是一种常见慢性病,引起肝硬化的病因
-
肝硬化的前期表现有哪些?肝硬化前期该如何选择软肝药品呢?
中国人的饮酒文化众所皆知,都特别喜欢酒桌
-
肝硬化患者吃什么药好,复方鳖甲软肝片有效吗?疗效值得认可
我国是肝病高发生率大国,每年有超过120万病
-
肝硬化吃复方鳖甲软肝片怎么样?复方鳖甲软肝片功效与作用来评价
肝硬化是一种常见的慢性肝病,是由一种或多
-
-
-
-
-
-
-
-
-
-
-
-
-
 优养在线
优养在线