创胜集团于ESMO 2023年会公布Osemitamab (TST001) 联合CAPOX...
最新数据揭示:扩展阶段所有接受治疗的患者中,55%确认缓解率,中位应达持续时间(DoR)及中位无进展生存期(PFS)超过12个月。
美国新泽西州普林斯顿和中国苏州2023年10月23日 /美通社/ -- 创胜集团(06628.HK),一家具备生物药品发现、研发、工艺开发和生产全流程整合能力的临床阶段的生物制药公司,宣布已于西班牙马德里举办的ESMO 2023年会公布TranStar102扩展队列研究中Osemitamab (TST001)联合卡培他滨和奥沙利铂(CAPOX)化疗一线治疗晚期胃或胃食管结合部腺癌(G/GEJ)的更新疗效数据。相较于先前公布的通过用于筛选患者的LDT免疫组化方法筛选CLDN18.2表达≥10%的肿瘤细胞的膜染色强度≥1+的患者的数据,更新数据进一步展现出令人鼓舞的疗效。亦公布两项墙报:一项是关于支持Osemitamab (TST001)、nivolumab和化疗的三联疗法优于Osemitamab (TST001)和化疗(包括PD-L1阴性肿瘤)的临床前数据;另一项则详述了支持推荐III期剂量的临床药理学探索。
"该等最新数据集进一步证实了Osemitamab (TST001)联合CAPOX化疗作为包括CLDN18.2表达水平较低的肿瘤在内的晚期胃或胃食管结合部腺癌一线治疗的疗效,并为在表达不同水平PD-L1 CPS的肿瘤病人中探索Osemitamab (TST001)与nivolumab和化疗三联疗法提供基本原理。"创胜集团全球药物开发执行副总裁,首席医学官Caroline Germa博士表示,"我们对疗效结果以及近期FDA批准公司开展全球III 期临床试验感到非常鼓舞,这表明Osemitamab (TST001)有望重新定义CLDN18.2阳性、HER2阴性胃或胃食管结合部腺癌患者的现行治疗标准。"
试验设计
Transtar102研究C队列( NCT04495296) 旨在探索Osemitamab (TST001) 联合CAPOX一线治疗晚期胃或胃食管结合部腺癌(G/GEJ)的安全性和有效性。该研究共有49例患者入组并接受疗效扩展队列6mg/kg Q3W的Osemitamab (TST001)联合CAPOX治疗。
49 例入组患者中,41 例患者的肿瘤呈CLDN18.2 阳性表达,另外8 例患者未进行生物标志物检测。使用经中心实验室验证的14G11 LDT免疫组化方法验证CLDN18.2表达,CLDN18.2 阳性肿瘤即用LDT方法≥10%的肿瘤细胞的膜染色强度≥1+,约占所有胃或胃食管连接部癌症患者的55%。
鼓舞人心且持久的中位缓解持续时间和中位无进展生存期数据
截至报告日期,49例患者的中位随访时间为11.3个月,最长治疗持续时间超过1.5年。在这49例患者中,42例患者在基线和至少一次基线后肿瘤评估中具有可测量病灶,其中28例患者出现部分缓解,23例患者确认缓解(54.8%,23/42),中位缓解持续时间(DoR)为12.7 个月。49例患者中有20例出现疾病进展或死亡,估计的中位无进展生存期(PFS)为14个月。由于事件数量有限,中位总生存期(mOS)尚未达到,C队列(64例患者,所有剂量)的12个月生存率为88.9%(95% CI:74.2, 95.4)。这进一步印证了本公司近期获FDA批准的III期试验策略的可行性,即将Osemitamab (TST001)与nivolumab和化疗联用,作为CLDN18.2阳性胃或胃食管结合部腺癌的一线治疗方案。
优异且可控的安全性
49例患者的安全性特征主要表现为可控的靶向非肿瘤效应,包括恶心、低白蛋白血症和呕吐,大部分为1级或2级,并发生在前2个周期。
此外,在大会上展示的临床前数据(#1560P) 显示,Osemitamab (TST001) 可显著上调胃癌细胞的PD-L1 表达,并促进肿瘤浸润淋巴细胞(TIL) 向肿瘤内浸润。在CLDN18.2 阳性/PD-L1 阴性的胃癌人源肿瘤异种移植(PDX)模型中,包括抗CLDN18.2抗体Osemitamab (TST001)与PD1抑制剂nivolumab和化疗联用,展现出显著的协同效应。在小鼠模型中,通过接受Osemitamab (TST001)联合nivolumab和化疗、Osemitamab (TST001)联合化疗、nivolumab联合化疗或仅化疗的治疗, 分别有5/8、2/8、0/8、0/8只小鼠达到了肿瘤消除。
在对接受Osemitamab (TST001)联合CAPOX一线治疗胃或胃食管结合部腺癌的58 例患者的数据进行的ER分析中,较长的PFS/DoR及更持久的ORR趋势与较高的Osemitamab (TST001)暴露有关,且与6mg/kg Q3W所达致的暴露范围一致。安全性ER分析显示,当剂量从3mg/kg Q3W增加至6mg/kg Q3W时,临床风险并无显著增加。Osemitamab (TST001)的初步疗效、安全性及PK/PD数据显示了优异的收益风险特征,并支持未来以6mg/kg Q3W或4mg/kg Q2W剂量进行探索。
关于Osemitamab (TST001)
Osemitamab (TST001) 是一种高亲和力的靶向CLDN18.2的人源化单克隆抗体,具有增强的抗体依赖性细胞毒性(ADCC),在异种移植试验中显示出强大的抗肿瘤活性。Osemitamab (TST001) 是全球范围内开发的第二个最先进的CLDN18.2靶向抗体药物,由本公司通过其免疫耐受突破(IMTB)技术平台开发。Osemitamab (TST001) 通过ADCC机制杀死表达CLDN18.2的肿瘤细胞。利用先进的生物加工技术,Osemitamab (TST001) 的岩藻糖含量在生产过程中大大降低,进一步增强了Osemitamab (TST001) 的NK细胞介导的ADCC活性。中国和美国均一直在进行Osemitamab (TST001) 的临床试验(NCT05190575、NCT04396821、NCT04495296、NCT05608785 / CTR20201281)。美国食品和药品监督管理局(FDA)已授予Osemitamab (TST001) 用于治疗胃癌或胃食管结合部腺癌和胰腺癌患者的孤儿药资格认定。
关于创胜集团
创胜集团是一家临床阶段的在生物药发现、研发、工艺开发和生产方面具有全面综合能力的生物制药公司。
创胜集团总部位于苏州,已成功搭建了全球的业务布局:在苏州设有药物发现、临床和转化研究中心,创胜集团总部及以连续灌流生产工艺为核心技术的生产基地也正在建设中。在杭州拥有工艺与产品开发中心以及药物生产基地,在美国普林斯顿、北京、上海、广州分别设有临床开发中心,并在美国波士顿、洛杉矶设立了业务拓展中心。创胜集团的开发管线已有十三个治疗用抗体新药分子,涵盖肿瘤、骨科和肾病等领域。
如需了解关于创胜集团的更多信息,请访问公司网站:www.transcenta.com或领英账号:Transcenta。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用"预期"、"相信"、"预测"、"期望"、"打算"及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
Transcenta和Osemitamab是Transcenta Holding Limited的商标。所有其他品牌和产品名称可能是其各自所有者的商标和/或注册商标。
本文RSS来源:美通社
-
维颜嘉西安国际医学中心新品发布会,中韩专家联袂推荐
杭州2024年11月24日 /美通社/ -- 2024年11月19日西安国际医学中心整形医院,维颜嘉新品发布会圆满落幕。会上,维颜嘉...[详细]
-
"爱肺骑行,你我相伴"2024健康骑行公益活动圆满举行
上海2024年11月23日 /美通社/ -- 11月是国际肺癌关注月,为提升全社会对肺部疾病的认知和关注,由复宏汉霖主办,上...[详细]
-
默沙东与中国癌症基金会签署HPV疫苗捐赠协议
加速消除宫颈癌 共筑HPV健康防线 北京2024年11月23日 /美通社/ -- 在今日举行的中国癌症基金会成立40周年纪念暨首届...[详细]
-
对您来说,干净的洗手间有多重要? 最新全球调查揭示后疫情时代人们对商用洗手间的看法
Excel Dryer, Inc.与MetrixLab的研究表明:如果洗手间不干净,顾客可能不会再光顾 马萨诸塞州东朗梅多20...[详细]
-
佳得乐与曼城球员共同揭晓 #THENOD 在足球场上的无声超凡力量
佳得乐 (Gatorade) 的广告牌现已正式出现在欧洲冠军联赛和足球游戏 EA SPORTS FC™25 的场边,实现了真实和虚拟足球世...[详细]
-
泰康拜博优秀病例荣誉入选ORF Talent Discovery全球病例大赛巅峰总决赛20...
上海、深圳和北京2024年11月22日 /美通社/ --近日,由口腔重建基金会(ORF)举办的2024口腔重建国际研讨会在湄南河...[详细]
-
-
药明康德获2024年EcoVadis企业社会责任评级"金牌"认证
上海2024年11月21日 /美通社/ -- 药明康德近日宣
-
擎科基因工厂揭秘(上):自研原料设备 打造全自主产业链
北京2024年11月21日 /美通社/ -- 合成科学融合了
-
擎科基因工厂揭秘(下):高效Oligo合成,基因合成最快3天内可交付
北京2024年11月21日 /美通社/ -- 在前篇文章中,
-
用于肌萎缩性脊髓侧索硬化症的注射用25毫克 ROZEALAMIN®(甲钴胺)在日本上市
东京2024年11月21日 /美通社/ -- 卫材宣布,肌萎
-
上海和睦家医院成功承办《国际产儿科适宜手术推广》国际交流会议
上海2024年11月21日 /美通社/ -- 2024年11月15日至1
-
理邦仪器AI超声项目获进一步赠款支持,助力改善妇幼健康
深圳2024年11月21日 /美通社/ -- 深
-
-
-
肝纤维化不能吃什么?肝纤维化饮食的注意事项有哪些?
中国人口14亿多,其中有9000万乙肝病毒感染者
-
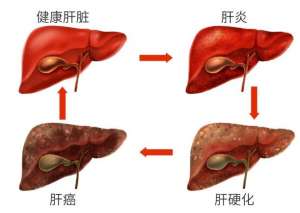
肝硬化需要全疗程用药吗?哪个品牌的软肝片好?用药讲疗程,安全有保证!
人们常说“慢性病要以慢治慢”。古人倡导“
-
肝硬化的突出表现有哪些?用什么药软肝效果好?保肝软肝就选中成药
肝硬化是一种常见慢性病,引起肝硬化的病因
-
肝硬化的前期表现有哪些?肝硬化前期该如何选择软肝药品呢?
中国人的饮酒文化众所皆知,都特别喜欢酒桌
-
肝硬化患者吃什么药好,复方鳖甲软肝片有效吗?疗效值得认可
我国是肝病高发生率大国,每年有超过120万病
-
肝硬化吃复方鳖甲软肝片怎么样?复方鳖甲软肝片功效与作用来评价
肝硬化是一种常见的慢性肝病,是由一种或多
-
-
-
-
-
-
-
-
-
-
-
-
-
 优养在线
优养在线