先为达宣布其长效GLP-1激动剂Ecnoglutide(XW003)中国成人2型糖尿病Ⅲ期...
- 受试者接受每周一次0.6 mg、1.2 mg Ecnoglutide注射治疗,持续24周,HbA1c分别较基线降低1.96%和2.43%,而安慰剂组为0.87%
- 在24周治疗结束时,1.2 mg Ecnoglutide治疗组高达76.1%的受试者HbA1c≤6.5%,35.2%的受试者HbA1c<5.7%
- Ecnoglutide安全性、耐受性良好,最常报告的不良事件为胃肠道反应
中国杭州和美国旧金山2024年1月3日 /美通社/ -- 杭州先为达生物科技股份有限公司,一家处于临床阶段、专注于发现和开发治疗代谢性疾病创新疗法的生物医药公司,今日公布其Ecnoglutide(XW003)中国成人2型糖尿病(T2DM)Ⅲ期临床试验的积极结果。Ecnoglutide是一种具有cAMP偏向性的长效胰高血糖素样肽-1(GLP-1)激动剂,正在开发用于治疗2型糖尿病和肥胖适应症。
该Ⅲ期临床试验(NCT05680155)是一项多中心、随机、双盲、安慰剂对照研究,在中国33家临床试验中心共计招募211名受试者,均为饮食运动干预后血糖控制不佳的成年2型糖尿病患者。受试者随机接受每周一次0.6 mg、1.2 mg Ecnoglutide或安慰剂治疗24周(含剂量递增期),研究的主要疗效终点为治疗24周后糖化血红蛋白(HbA1c)相对基线的改变。受试者在完成24周双盲治疗后进入开放治疗期,继续接受目标剂量0.6 mg或1.2 mg Ecnoglutide的治疗,总治疗期为52周。本研究评估项目包括受试者平均HbA1c、体重、体重指数(BMI)等的变化,以及药物的安全性与耐受性。受试者的基线平均HbA1c为8.5%,平均体重为73公斤。
治疗24周后,Ecnoglutide显著降低了受试者HbA1c水平,大多数受试者HbA1c低于7%(美国糖尿病协会推荐的糖尿病患者治疗目标),相当一部分降低至正常水平范围(低于5.7%)。同时,Ecnoglutide组受试者的体重也显著下降。本研究的核心顶线疗效结果总结于下表:
疗效总结
第24周数据 | 安慰剂组 (N=71) | 0.6 mg Ecnoglutide (N=69) | 1.2 mg Ecnoglutide (N=71) |
HbA1c较基线变化 | -0.87 % | -1.96% (P=0.0003) | -2.43% (P<0.0001) |
HbA1c<7% 受试者比例 | 21.1 % | 68.1 % | 80.3 % |
HbA1c≤6.5% 受试者比例 | 12.7 % | 52.2 % | 76.1 % |
HbA1c<5.7% 受试者比例 | 0 % | 10.1 % | 35.2 % |
体重较基线变化 | -2.02 % | -4.51% (P=0.0002) | -4.74% (P<0.0001) |
本研究中,Ecnoglutide总体安全性和耐受性与GLP-1受体激动剂的已知安全性特征一致,最常见的不良事件包括食欲下降、腹泻和恶心,大多数事件的严重程度为轻中度,整个试验仅有3名受试者(每组1名,占比1.4%)因不良事件终止研究。
“我们非常高兴看到Ecnoglutide在中国的首个Ⅲ期临床试验取得了积极结果。经过为期24周的治疗后, Ecnoglutide降低HbA1c的优越数据,与GLP-1/GIP双靶点激动剂(如替尔泊肽)相当。”先为达创始人、CEO潘海博士说,“我们在临床研究中观察到Ecnoglutide的强大疗效符合其cAMP偏向性的作用机制。”
该项2型糖尿病Ⅲ期临床试验预计将于2024年上半年完成。除此研究外,Ecnoglutide还在进行另外两项Ⅲ期临床试验,分别研究Ecnoglutide对比度拉糖肽在2型糖尿病中的疗效(NCT05680129)、Ecnoglutide对比安慰剂在超重/肥胖患者中的疗效(NCT05813795)。这两项试验均已完成受试者入组,其研究结果预计将在2024年下半年公布。
本文RSS来源:美通社
-
对您来说,干净的洗手间有多重要? 最新全球调查揭示后疫情时代人们对商用洗手间的看法
Excel Dryer, Inc.与MetrixLab的研究表明:如果洗手间不干净,顾客可能不会再光顾 马萨诸塞州东朗梅多20...[详细]
-
佳得乐与曼城球员共同揭晓 #THENOD 在足球场上的无声超凡力量
佳得乐 (Gatorade) 的广告牌现已正式出现在欧洲冠军联赛和足球游戏 EA SPORTS FC™25 的场边,实现了真实和虚拟足球世...[详细]
-
泰康拜博优秀病例荣誉入选ORF Talent Discovery全球病例大赛巅峰总决赛20...
上海、深圳和北京2024年11月22日 /美通社/ --近日,由口腔重建基金会(ORF)举办的2024口腔重建国际研讨会在湄南河...[详细]
-
卫材抗癌药物"TASFYGO®片剂35mg"在日本上市
用于治疗携带FGFR2基因融合或重排的胆道癌 东京2024年11月22日 /美通社/ -- 卫材宣布,已在日本上市成纤维细胞生长...[详细]
-
先瑞达血栓抽吸导管专用支撑管获NMPA批准上市
北京2024年11月22日 /美通社/ -- 2024年11月21日,先瑞达血栓抽吸导管专用支撑管获NMPA批准上市,该产品适用于在外周...[详细]
-
合创新生:富士胶片生命科学整体解决方案助力辅助生殖
上海2024年11月22日 /美通社/ -- 2024年11月12日-11月17日,由中华医学会、中华医学会生殖医学分会主办的中华医学会第...[详细]
-
-
晨泰医药佐利替尼片(泽瑞尼®)获批上市
晨泰医药佐利替尼片(泽瑞尼®)是全球首个
-
药明康德获2024年EcoVadis企业社会责任评级"金牌"认证
上海2024年11月21日 /美通社/ -- 药明康德近日宣
-
FAIR PLAY MENARINI : “THE CHAMPIONS TELL THEI...
意大利佛罗伦萨2024年11月21日 /美
-
擎科生物2024年高分文献集锦,前沿研究与产品创新助力科研突破
北京2024年11月21日 /美通社/ -- 自成立以来,擎
-
擎科基因工厂揭秘(下):高效Oligo合成,基因合成最快3天内可交付
北京2024年11月21日 /美通社/ -- 在前篇文章中,
-
擎科基因工厂揭秘(上):自研原料设备 打造全自主产业链
北京2024年11月21日 /美通社/ -- 合成科学融合了
-
-
-
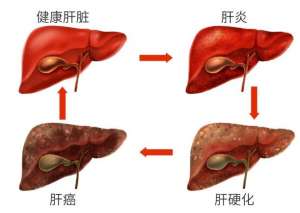
肝纤维化不能吃什么?肝纤维化饮食的注意事项有哪些?
中国人口14亿多,其中有9000万乙肝病毒感染者
-
肝硬化需要全疗程用药吗?哪个品牌的软肝片好?用药讲疗程,安全有保证!
人们常说“慢性病要以慢治慢”。古人倡导“
-
肝硬化的突出表现有哪些?用什么药软肝效果好?保肝软肝就选中成药
肝硬化是一种常见慢性病,引起肝硬化的病因
-
肝硬化的前期表现有哪些?肝硬化前期该如何选择软肝药品呢?
中国人的饮酒文化众所皆知,都特别喜欢酒桌
-
肝硬化患者吃什么药好,复方鳖甲软肝片有效吗?疗效值得认可
我国是肝病高发生率大国,每年有超过120万病
-
肝硬化吃复方鳖甲软肝片怎么样?复方鳖甲软肝片功效与作用来评价
肝硬化是一种常见的慢性肝病,是由一种或多
-
-
-
-
-
-
-
-
-
-
-
-
-
 优养在线
优养在线