传奇生物CARTITUDE-4四项研究成果即将亮相2024ASH年会
 |
最新数据将展示显著且持续提高的微小残留病(MRD)阴性率,进一步强化了CARVYKTI改变难治性多发性骨髓瘤治疗结局的潜力。
MRD数据将在第 66届美国血液学会 (ASH) 年会上进行口头报告
南京2024年11月6日 /美通社/ -- 当地时间2024年11月5日,传奇生物(NASDAQ: LEGN)在美国新泽西萨默特将公布3期CARTITUDE-4研究最新的微小残留病(MRD)阴性率数据。该研究评估了对来那度胺耐药且既往接受过一至三线治疗的多发性骨髓瘤患者接受CARVYKTI®(西达基奥仑赛,cilta-cel)或标准治疗(SoC)的疗效对比。该数据将于2024年12月9日(星期一)太平洋时间下午5:45在圣地亚哥举行的第 66 届ASH年会上进行口头报告。
传奇生物首席执行官黄颖博士表示:"今年的ASH数据继续凸显了我们在关键临床领域的进展,这些进展旨在帮助医疗保健专业人员为多发性骨髓瘤患者决定最佳治疗方案。MRD阴性率是多发性骨髓瘤患者生存期延长的预后标志。总体和持续MRD阴性率的显著提高进一步支持了CARVYKTI®在多发性骨髓瘤的二线治疗中,相较于标准疗法,是一种变革性的治疗选择。"
来自CARTITUDE-4的数据支持了美国食品药品监督管理局(FDA)和欧盟委员会(EC)在今年早些时候批准CARVYKTI®用于治疗复发或难治性多发性骨髓瘤成人患者,这些患者既往至少接受过一线治疗,包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药。CARVYKTI®是首款且唯一获批用于治疗既往至少接受过一线治疗的多发性骨髓瘤患者的靶向BCMA CAR-T细胞疗法。在全球范围内,CARVYKTI目前已在五个国家上市,治疗患者已逾4000名。
ASH 演讲(2024 年 12 月 7-10 日)
摘要标题 | 作者 | 会议详情 |
西达基奥仑赛(Cilta-cel) 对比准疗法 (SoC) 在既往接 受1-3线治疗且对来那度胺 耐药的多发性骨髓瘤患者: 3 期研究CARTITUDE-4的微 小残留病(MRD)阴性率数 据 | Rakesh Popat, Albert Oriol, Michele Cavo, Lionel Karlin, Irit Avivi, Wilfried Roeloffzen, Seok Jin Kim, Brea Lipe, Noffar Bar, Noemi Horvath, Andrew Spencer, Chang Ki Min, Diana Chen, Quanlin Li, Katherine Li, Ana Slaughter, Carolina Lonardi, Nina Benachour, Arnab Ghosh, Martin Vogel, Nikoletta Lendvai, Tamar Lengil, Nitin Patel, Octavio Costa Filho, Erika Florendo, Yi Lin | 口头报告编号:1032 会议名称:655.多发性骨髓 瘤:细胞疗法:释放细胞疗 法对抗骨髓瘤 报告时间:2024年12月9日 下午5:45-6:00(太平洋时间) |
西达基奥仑赛(Cilta-cel) 对比标准疗法,在来那度胺 耐药的多发性骨髓瘤患者中 的报告结局和下一次抗骨髓 瘤治疗时间上的长期获益: 来自3期研究CARTITUDE- 4临床试验结果 | Noffar Bar, Roberto Mina, Anne K. Mylin, Hisayuki Yokoyama, Hila Magen, Winfried Alsdorf, Monique C. Minnema, Leyla Shune, Iris Isufi, Simon J. Harrison, Urvi A. Shah, André De Champlain, Katherine S. Gries, Diana Chen, Quanlin Li, Tzu-Min Yeh, Ana Slaughter, Carolina Lonardi, Nina Benachour, Arnab Ghosh, William Deraedt, Martin Vogel, Nikoletta Lendvai, Nitin Patel, Octavio Costa Filho, Erika Florendo, Lionel Karlin, Katja Weisel | 海报编号:2002 会议名称:655.多发性骨髓 瘤:细胞疗法:海报展示I 展示时间:2024年12月7日下 午6:00-8:00(太平洋时间) |
采用匹配调整的间接比较 法,对比更新西达基奥仑赛 与Idecabtagene Vicleucel 在既往接受过 2-4 线治疗的 复发性或难治性多发性骨髓 瘤患者中的疗效 | Nieves Lopez-Muñoz, Noffar Bar, Joris Diels, Suzy Van Sanden, João Mendes, Seina Lee, Teresa Hernando, Nikoletta Lendvai, Nitin Patel, Tadao Ishida, Jeremy Er, Simon J. Harrison, Urvi Shah | 海报编号:3390 会议名称:655.多发性骨髓 瘤:细胞疗法:海报II 展示时间:2024年12月8日 下午6:00-8:00(太平洋时间) |
使用逆概率加权法(IPTW) 比较CARVYKTI在 CARTITUDE-4研究中与其 他常规治疗方案对来那度胺 耐药的多发性骨髓瘤患者的 疗效 | Rafael Fonseca, Joris Diels, Francesca Ghilotti, João Mendes, Teresa Hernando, Seina Lee, Jordan M. Schecter, Nikoletta Lendvai, Nitin Patel, Ana Triguero, Winfried Alsdorf, Margherita Ursi | 海报编号:2005 会议名称:655. 多发性骨髓 瘤:细胞疗法:海报展示I 展示时间:2024年12月7 日 下午5:30-7:30(太平洋时间) |
关于CARVYKTI®(CILTA-CEL,西达基奥仑赛)
西达基奥仑赛是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体T细胞(CAR-T)疗法,使用嵌合抗原受体(CAR)的转基因对患者自身的T细胞进行修饰,以识别和消除表达BCMA的细胞。BCMA主要表达于恶性多发性骨髓瘤B细胞谱系、晚期B细胞和浆细胞的表面。西达基奥仑赛的CAR蛋白具有两种靶向BCMA单域抗体,对表达BCMA的细胞具有高亲和力,在与表达BCMA的细胞结合后,CAR可促进T细胞活化、扩增,继而清除靶细胞[1]。
2017年12月,杨森与传奇生物签订了全球独家许可和合作协议,以开发和商业化西达基奥仑赛。2022年2月,西达基奥仑赛获得美国食品药品监督管理局(FDA)批准上市,5月获得欧盟委员会(EC)授予的附条件上市许可,9月获得日本厚生劳动省(MHLW)批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,商品名为CARVYKTI®。2024年4月,西达基奥仑赛先后被美国FDA、欧盟委员会批准用于复发或难治性多发性骨髓瘤患者的二线治疗,对这些患者既往至少接受过一线治疗,包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药。2024年8月,西达基奥仑赛获得国家药品监督管理局(NMPA)批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
西达基奥仑赛于2019年12月在美国和2020年8月在中国获得突破性疗法认定。此外,西达基奥仑赛于2019年4月获得欧盟委员会优先药物资格认定。美国FDA、欧洲EMA和日本PMDA分别于2019年2月、2020年2月及2020年6月授予西达基奥仑赛孤儿药资格认定。2022年3月,欧洲药品管理局的孤儿药品委员会一致建议,根据临床数据(治疗后完全缓解率有所改善且持续存在)维持西达基奥仑赛的孤儿药认定。
关于CARTITUDE-4
CARTITUDE-4 (
关于多发性骨髓瘤
多发性骨髓瘤被认为是不可治愈的血液肿瘤,是由于骨髓中的浆细胞过度增殖导致的恶性疾病[3]。预计2024年美国将有超过35000人被诊断为多发性骨髓瘤,超过12000人死于该疾病[4]。虽然一些多发性骨髓瘤患者无明显症状,大多数患者是由于出现症状而被确诊,这些症状可能包括骨病、低血细胞计数异常、血钙升高、肾脏问题或感染等[5]。
关于传奇生物
传奇生物(NASDAQ:LEGN)成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司,位列全球免疫细胞疗法领域第一方阵,全球员工总数逾2000人。目前通过与杨森的合作,首款产品西达基奥仑赛(cilta-cel)于2022年获得美国食品药品监督管理局(FDA)、日本厚生劳动省(MHLW)批准上市,并获得欧盟委员会(EC)附条件上市许可,有望解决多发性骨髓瘤治疗的世界级难题。2022年底,国家药品监督管理局正式受理西达基奥仑赛的新药上市申请(NDA),并于2023年1月纳入优先审评程序。2024年8月,西达基奥仑赛在中国批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。此外,公司还有多款在研细胞疗法,用于血液瘤、实体瘤及其它疑难疾病的治疗。
更多信息请访问:www.legendbiotech.cn
关于前瞻性陈述的注意事项
本新闻稿中关于未来预期、计划和前景的陈述,以及关于非历史事实事项的任何其他陈述,均构成1995年《私人证券诉讼改革法案》所指的“前瞻性陈述”。这些陈述包括但不限于:与传奇生物的战略和目标的有关表述;与CARVYKTI®有关的陈述,包括传奇生物对CARVYKTI®及其治疗潜力的预期;与 CARTITUDE 临床开发项目中正在进行的研究的潜在结果有关的陈述;以及传奇生物候选产品的潜在优势。“预期”、“相信”、“继续”、“可能”、“估计”、“期望”、“打算”、“可以”、“计划”、“潜在”、“预测”、“预计”、“应该”、“目标”、“将”、“会”和类似表达旨在识别前瞻性陈述,但并非所有前瞻性陈述都包含这些识别词。尽管并非所有前瞻性表述都包含这些识别词,但类似表述旨在识别前瞻性表述。由于各种重要因素的影响,实际结果可能与这些前瞻性陈述所显示的结果存在实质性差异。传奇生物技术公司的预期可能会受到以下因素的影响:新药开发过程中的不确定性;意外的临床试验结果,包括对现有临床数据的额外分析或意外的新临床数据;意外的监管行动或延迟,包括要求提供额外的安全性和/或有效性数据或数据分析,或政府的一般监管;由于我们的第三方合作伙伴采取行动或不采取行动而造成的意外延迟;传奇生物技术公司的专利或其他专有知识产权保护受到挑战而产生的不确定性,包括美国诉讼过程中的不确定性;政府、行业和一般产品定价及其他政治压力;以及传奇生物于2024年3月19日向美国证券交易委员会提交的20-F表格年度报告的“风险因素”部分所讨论的其他因素。如果以上一项或多项风险或不确定性成为现实,或者如果基本假设被证明不正确,则实际结果可能与本新闻稿中所述的预期、相信、估计或期望的结果存在重大差异。本新闻稿中包含的任何前瞻性陈述仅代表截至本新闻稿发布之日的情况。传奇生物明确声明,无论是由于新信息、未来事件还是其他原因,均不承担更新任何前瞻性陈述的义务。
参考文献:
[1] CARVYKTI™ 处方信息。Horsham, PA: Janssen Biotech, Inc.
[2] ClinicalTrials.Gov. 一项针对B细胞成熟抗原(BCMA)的CAR-T疗法JNJ-68284528与泊马度胺、硼替佐米和地塞米松(PVd)或达雷妥尤单抗、泊马度胺和地塞米松(DPd)在复发和来那度胺耐药的多发性骨髓瘤(CARTITUDE-4)患者中的比较研究。https://www.clinicaltrials.gov/study/NCT04181827. 2024年3月.
[3] 美国癌症协会。多发性骨髓瘤简介:https://www.cancer.org/cancer/types/multiple-myeloma/about/what-is-multiple-myeloma.html. 2024年3月.
[4] 美国癌症协会。"关于多发性骨髓瘤的关键统计数据"
[5] 美国癌症协会。多发性骨髓瘤:早期发现、诊断和分期.
本文RSS来源:美通社
-
默沙东与中国癌症基金会签署HPV疫苗捐赠协议
加速消除宫颈癌 共筑HPV健康防线 北京2024年11月23日 /美通社/ -- 在今日举行的中国癌症基金会成立40周年纪念暨首届...[详细]
-
对您来说,干净的洗手间有多重要? 最新全球调查揭示后疫情时代人们对商用洗手间的看法
Excel Dryer, Inc.与MetrixLab的研究表明:如果洗手间不干净,顾客可能不会再光顾 马萨诸塞州东朗梅多20...[详细]
-
佳得乐与曼城球员共同揭晓 #THENOD 在足球场上的无声超凡力量
佳得乐 (Gatorade) 的广告牌现已正式出现在欧洲冠军联赛和足球游戏 EA SPORTS FC™25 的场边,实现了真实和虚拟足球世...[详细]
-
泰康拜博优秀病例荣誉入选ORF Talent Discovery全球病例大赛巅峰总决赛20...
上海、深圳和北京2024年11月22日 /美通社/ --近日,由口腔重建基金会(ORF)举办的2024口腔重建国际研讨会在湄南河...[详细]
-
卫材抗癌药物"TASFYGO®片剂35mg"在日本上市
用于治疗携带FGFR2基因融合或重排的胆道癌 东京2024年11月22日 /美通社/ -- 卫材宣布,已在日本上市成纤维细胞生长...[详细]
-
先瑞达血栓抽吸导管专用支撑管获NMPA批准上市
北京2024年11月22日 /美通社/ -- 2024年11月21日,先瑞达血栓抽吸导管专用支撑管获NMPA批准上市,该产品适用于在外周...[详细]
-
-
药明康德获2024年EcoVadis企业社会责任评级"金牌"认证
上海2024年11月21日 /美通社/ -- 药明康德近日宣
-
FAIR PLAY MENARINI : “THE CHAMPIONS TELL THEI...
意大利佛罗伦萨2024年11月21日 /美
-
擎科基因工厂揭秘(上):自研原料设备 打造全自主产业链
北京2024年11月21日 /美通社/ -- 合成科学融合了
-
擎科生物2024年高分文献集锦,前沿研究与产品创新助力科研突破
北京2024年11月21日 /美通社/ -- 自成立以来,擎
-
擎科基因工厂揭秘(下):高效Oligo合成,基因合成最快3天内可交付
北京2024年11月21日 /美通社/ -- 在前篇文章中,
-
理邦仪器AI超声项目获进一步赠款支持,助力改善妇幼健康
深圳2024年11月21日 /美通社/ -- 深
-
-
-
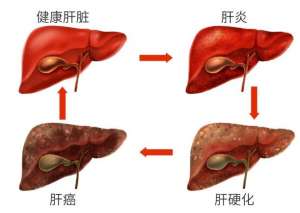
肝纤维化不能吃什么?肝纤维化饮食的注意事项有哪些?
中国人口14亿多,其中有9000万乙肝病毒感染者
-
肝硬化需要全疗程用药吗?哪个品牌的软肝片好?用药讲疗程,安全有保证!
人们常说“慢性病要以慢治慢”。古人倡导“
-
肝硬化的突出表现有哪些?用什么药软肝效果好?保肝软肝就选中成药
肝硬化是一种常见慢性病,引起肝硬化的病因
-
肝硬化的前期表现有哪些?肝硬化前期该如何选择软肝药品呢?
中国人的饮酒文化众所皆知,都特别喜欢酒桌
-
肝硬化患者吃什么药好,复方鳖甲软肝片有效吗?疗效值得认可
我国是肝病高发生率大国,每年有超过120万病
-
肝硬化吃复方鳖甲软肝片怎么样?复方鳖甲软肝片功效与作用来评价
肝硬化是一种常见的慢性肝病,是由一种或多
-
-
-
-
-
-
-
-
-
-
-
-
-
 优养在线
优养在线